Giải bài 1 trang 130 SGK Hóa 8
Bài 1: Hãy chép vào vở bài tập các câu sau đây và thêm vào chỗ trống những từ thích hợp
Axit là hợp chất mà phân tử gồm có một hay nhiều … liên kết với … Các nguyên tử hiđro này có thể thay thế bằng …
Bazơ là hợp chất mà phân tử có một … liên kết với một hay nhiều nhóm …
Lời giải:
Axit là hợp chất mà phân tử gồm có một hay nhiều nguyên tử hiđro liên kết với gốc axit. Các nguyên tử hiđro này có thể thay thế bằng nguyên tử kim loại.
Bazơ là hợp chất mà phân tử có một nguyên tử kim loại liên kết với 1 hay nhiều nhóm hiđroxit (-OH).
Giải bài 2 trang 130 SGK Hóa 8
Bài 2: Hãy viết công thức hóa học của các axit có gốc axit cho dưới đây và cho biết tên của chúng:
-Cl, =SO3 , =SO4 , -HSO4 , =CO3 , ≡PO4 , =S, -Br, -NO3.
Lời giải:
Công thức hóa học của các axit là:
HCl: axit clohidric.
H2SO4: axit sunfuric.
H2SO3: axit sunfurơ.
H2CO3: axit cacbonic.
H3PO4: axit photphoric.
H2S: axit sunfuhiđric.
HBr: axit bromhiđric.
HNO3: axit nitric.
Giải bài 3 trang 130 SGK Hóa 8
Bài 3: Hãy viết công thức hóa học của những oxit axit tương ứng với những axit sau: H2SO4, H2SO3, H2CO3, HNO3, H3PO4.
Lời giải:
Công thức hóa học của những oxit axit tương ứng với các axit là:
H2SO4 oxit axit là: SO3.
H2SO3 oxit axit là: SO2.
H2CO3 oxit axit là: CO2.
HNO3 oxit axit là: NO2.
H3PO4 oxit axit là: P2O5.
Giải bài 4 trang 130 SGK Hóa 8
Bài 4: Viết công thức hóa học của bazơ tương ứng với các oxit sau đây:
Na2O, Li2O, FeO, BaO, CuO, Al2O3.
Lời giải:
Công thức hóa học của các bazơ tương ứng với các oxit là:
NaOH tương ứng với Na2O.
LiOH tương ứng với Li2O.
Cu(OH)2 tương ứng với CuO.
Fe(OH)2 tương ứng với FeO.
Ba(OH)2 tương ứng với BaO.
Al(OH)3 tương ứng với Al2O3.
Giải bài 5 trang 130 SGK Hóa 8
Bài 5: Viết công thức hóa học của oxit tương ứng với các bazơ sau đây:
Ca(OH)2, Mg(OH)2, Zn(OH)2, Fe(OH)2.
Lời giải:
CaO tương ứng với Ca(OH)2.
MgO tương ứng với Mg(OH)2.
ZnO tương ứng với Zn(OH)2.
FeO tương ứng với Fe(OH)2.
Giải bài 6 trang 130 SGK Hóa 8
Bài 6: Đọc tên của những chất có công thức hóa học ghi dưới đây:
a) HBr, H2SO3, H3PO4, H2SO4.
b) Mg(OH)2, Fe(OH)3, Cu(OH)2.
c) Ba(NO3)2, Al2(SO4)3, Na2SO3, ZnS, Na2HPO4, NaH2PO4.
Lời giải:
Đọc tên các chất
a) Axit bromhiđric, axit sunfurơ, axit photphoric, axit sunfuric.
b) Magie hiđroxit, sắt(III) hiđroxit, đồng(II) hiđroxit.
c) Bari nitrat, nhôm sunfat, natri sunfit, kẽm sunfua, natri hiđrophotphat, natri đihiđrophotphat.
Lý thuyết Hóa học 8 Bài 37: Axit – Bazơ – Muối
1. Axit
a. Khái niệm
Phân tử axit gồm có một hay nhiều nguyên tử hihdro liên kết với gốc axit, các nguyên tử hidro này có thể thay thế bằng các nguyên tử kim loại
b. CTHH: gồm một hay nhiều nguyên tử H và gốc axit
c. Phân loại: 2 loại
– Axit không có oxi: HCl, H2S,….
– Axit có oxi: H2SO4, H2CO3,…
d. Tên gọi
– Axit không có oxi
Tên axit = axit + tên phi kim + hidric
VD: HCl: axit clohidric. Gốc axit tương ứng là clorua
H2S: axit sunfuhidric. Gốc axit tương ứng là sunfua
– Axit có oxi
+ Axit có nhiều oxi:
Tên axit = axit + tên phi kim + ic
VD: H2SO4 : axit sunfuric. Gốc axit: sunfat
HNO3: axit nitric. Gốc axit: nitrat
+ Axit có ít oxi:
Tên axit = axit + tên phi kim + ơ
VD: H2SO3 : axit sunfuro. Gốc axit sunfit
2. Bazơ
a. Khai niệm:
Phân tử bazo gồm có môt nguyên tử kim loại liên kết với một hay nhiều nhóm hidroxit (-OH).
b. CTHH: M(OH)n , n: số hóa trị của kim loại
c. Tên gọi:
Tên bazo = tên kim loại ( kèm hóa trị nếu có nhiều hóa trị) + hidroxit
VD: Fe(OH)2: sắt (II) hidroxit
KOH: kali hidroxit
d. Phân loại
Bazơ tan trong nước gọi là kiềm. VD: NaOH, KOH, Ca(OH)2, Ba(OH)2.
Bazơ không tan trong nước. VD: Cu(OH)2, Fe(OH)2, Fe(OH)3,…
3. Muối
a. Khái niệm
Phân tử muối có một hay nhiều nguyên tử kim loại liên kết với môht hay nhiều gốc axit
b. CTHH: gồm 2 phần: kim loại và gốc axit
VD: Na2SO4, CaCO3,…
c. Tên gọi
Tên muối = tên kim loại (kèm hóa trị nếu có nhiều hóa trị) + tên gốc axit
VD: Na2SO4 : natri sunfat
CaCO3: canxi cacbonat
FeSO4: sắt (II) sunfat
d. Phân loại
– Muối trung hòa: là muối mà trong gốc axit không có nguyên tử hidro có thể thay thế bằng các nguyên tử kim loại
VD: Na2SO4, CaCO3,…
– Muối axit: là muối trong đó gốc axit còn nguyên tử hidro H chưa được thay thế bằng nguyên tử kim loại. Hóa trị của gốc axit bằng số nguyên tử hidro đã được thay thế bằng các nguyên tử kim loại.
VD: NaHSO4, NaHS, NaHSO3,…
Bài tập tự luyện
Bài 1: Oxit tương ứng với axit H2SO3 là
A. SO2.
B. SO3.
C. SO.
D. CO2.
Lời giải:
Oxit tương ứng với axit H2SO3 là SO2
Đáp án cần chọn là: A
Bài 2: Cho các chất sau: H2SO4, HCl, NaCl, CuSO4, NaOH, Mg(OH)2. Số chất thuộc loại axit là:
A. 1
B. 2
C. 3
D. 4
Lời giải:
Các chất thuộc loại axit là: H2SO4, HCl →→ có 2 chất
Đáp án cần chọn là: B
Bài 3: Dãy dung dịch nào dưới đây làm đổi màu quỳ tím thành xanh?
A. NaOH, BaCl2, H3PO4, KOH.
B. NaOH, Na2SO4, KCl, KOH.
C. NaOH, Ba(OH)2, Ca(OH)2, KOH.
D. NaOH, Ca(NO3)2, KOH, H2SO4.
Lời giải:
Dãy dung dịch làm đổi màu quỳ tím thành xanh là dãy gồm các dung dịch bazơ: NaOH, Ba(OH)2, Ca(OH)2, KOH
Đáp án cần chọn là: C
Bài 4: Tên gọi của Al(OH)3 là:
A. Nhôm (III) hidroxit.
B. Nhôm hidroxit.
C. Nhôm (III) oxit.
D. Nhôm oxit.
Lời giải:
Al(OH)3: nhôm hidroxit
Đáp án cần chọn là: B
Chú ý: Không gọi là Nhôm (III) hidroxit vì nhôm chỉ có 1 hóa trị III. Cách gọi này chỉ ứng với kim loại có nhiều hóa trị
Bài 5: Cho 0,1 mol NaOH tác dụng với 0,2 mol HCl, sản phẩm sinh ra sau phản ứng là muối NaCl và nước. Khối lượng muối NaCl thu được là
A. 11,7 gam.
B. 5,85 gam.
C. 4,68 gam.
Lời giải:
PTHH: NaOH + HCl → NaCl + H2O
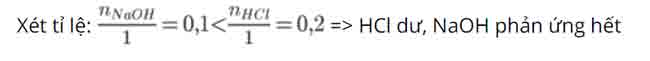
→ tính số mol NaCl theo NaOH
PTHH: NaOH + HCl → NaCl + H2O
Tỉ lệ PT: 1mol 1mol 1mol
P/ứng: 0,1mol → 0,1mol
→ Khối lượng muối NaCl thu được là: mNaCl = 0,1.58,5 = 5,85 gam
Đáp án cần chọn là: B
Bài 6: Khối lượng muối thu được khi cho 9,75 gam kẽm tác dụng với 9,8 gam axit sunfuric (H2SO4) là
A. 24,15 gam
B. 19,32 gam
C. 16,1 gam
D. 17,71 gam
Lời giải:
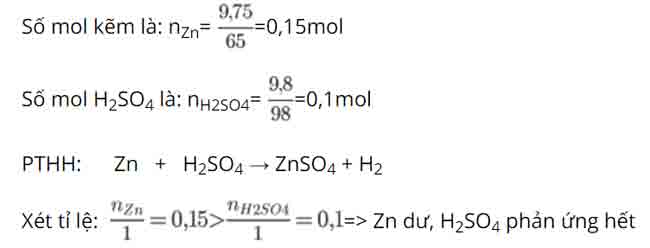
→ tính số mol muối ZnSO4 theo số mol H2SO4
PTHH: Zn + H2SO4 → ZnSO4 + H2
Tỉ lệ PT: 1mol 1mol 1mol
P/ứng: 0,1mol → 0,1mol
→ Khối lượng ZnSO4 là: mZnSO4=0,1.161=16,1gam
Đáp án cần chọn là: C
Trắc nghiệm Hóa học 8 Bài 37 (có đáp án): Axit – Bazơ – Muối
Câu 1: Để nhận biết HCl, NaOH, MgSO4 ta dùng:
A. Quỳ tím
B. Phenolphtalein
C. Kim loại
D. Phi kim
Hiển thị đáp án
Đáp án: A
Câu 2: Tên gọi của NaOH:
A. Natri oxit
B. Natri hidroxit
C. Natri (II) hidroxit
D. Natri hidrua
Hiển thị đáp án
Đáp án: B
Câu 3: Gốc axit của axit HNO3 hóa trị mấy?
A. 2
B. 3
C. 1
D. 4
Hiển thị đáp án
Đáp án: C
Câu 4: Bazơ không tan trong nước là:
A. Cu(OH)2
B. NaOH
C. KOH
D. Ca(OH)2
Hiển thị đáp án
Đáp án: A
Câu 5: Công thức của bạc clorua là:
A. AgCl2
B. Ag2Cl
C. Ag2Cl3
D. AgCl
Hiển thị đáp án
Đáp án: D
Câu 6: Muối nào trong đó có kim loại hóa trị II trong các muối sau: Al2(SO4)3; Na2SO4; K2SO4; BaCl2; CuSO4
A. K2SO4; BaCl2
B. Al2(SO4)3
C. BaCl2; CuSO4
D. Na2SO4
Hiển thị đáp án
Đáp án: C
Câu 7: Chất không tồn tại là:
A. NaCl
B. CuSO4
C. BaCO3
D. HgCO3
Hiển thị đáp án
Đáp án: D
Câu 8: Chọn câu đúng:
A. Các hợp chất muối của Na và K hầu như không tan
B. Ag2SO4 là chất ít tan
C. H3PO4 là axit mạnh
D. CuSO4 là muối không tan
Hiển thị đáp án
Đáp án: B
Câu 9: Chọn câu sai:
A. Axit luôn chứa nguyên tử H
B. Tên gọi của H2S là axit sunfuhidric
C. BaCO3 là muối tan
D. NaOH bazo tan
Hiển thị đáp án
Đáp án: C
Câu 10: Tên gọi của H2SO3
A. Hidro sunfua
B. Axit sunfuric
C. Axit sunfuhiđric
D. Axit sunfuro
Hiển thị đáp án
Đáp án: D
Hoá học 8 Bài 37 Axit Bazơ Muối
Tóm tắt lý thuyết
1.1. Axit
1.1.1. khái niệm
- Phân tử axít gồm một hay nhiều nguyên tử hiđrô liên kết với gốc axít, các nguyên tử hiđrô này có thể thay thế bằng các nguyên tử kim loại.
- Ví dụ: HCl (1 nguyên tử H + gốc axit -Cl); H2SO4 (2nguyên tử H và gốc axit =SO4)
1.1.2. Công thức của axít
Công thức: CHnA
- n: là chỉ số của nguyên tử H
- A: là gốc axít
1.1.3. Phân loại
- Axit không có oxi: HCl, H2S…
- Axit có oxi: HNO3, H2SO4, H3PO4 …
1.1.4. Tên gọi
*Axít có oxi
- Cách gọi tên: Tên axit: axit + tên Phi kim +ic
- Ví dụ: HNO3 (Axit nitric), H2SO4 (Axit sunfuric)…
*Axít không có oxi
- Cách gọi tên: axit + tên phi kim +hiđic
- Ví dụ: H2S (axit sunfuhiđric), HCl (axit clohiđric)…
*Axít có ít oxi
- Cách gọi tên: axit + PK + ơ
- Ví dụ: H2SO3 (axit sunfurơ). Gốc =SO3 có tên là sunfit
1.2. Bazơ
1.2.1. Khái niệm
- Ví dụ một số bazơ: NaOH, KOH, Ca(OH)2, Al(OH)3…
- Nhận xét:
- Có một nguyên tử kim loại.
- Một hay nhiều nhóm OH (hidroxit).
- Vì nhóm – OH luôn có hoá trị I.
- Số nhóm – OH được xác định bằng hoá trị của kim loại.
- Kết luận: Bazơ là một phân tử gồm một nguyên tố kim loại liên kết một hay nhiều nhóm hiđroxit(-OH).
1.2.2. Công thức hóa học
Công thức: M(OH)n
- M: là nguyên tố kim loại
- n: là chỉ số của nhóm (-OH)
1.2.3. Phân loại bazơ
- Bazơ tan (kiềm), tan được trong nước: NaOH; Ca(OH)2…
- Bazơ không tan, không tan được trong nước: Fe(OH)3; Cu(OH)2…
1.2.4. Tên gọi
- Tên bazơ = Tên kim loại( nếu kim loại có nhiều hoá trị gọi tên kèm theo tên hoá trị) + hiđroxit.
- Ví dụ: Ca(OH)2 Canxi hidroxit; Fe(OH)3 sắt (III) hiđroxit.
1.3. Muối
1.3.1. Khái niệm
- Phân tử muối gồm có một hay nhiều nguyên tử kim loại liên kết một hay nhiều gốc axít.
- Ví dụ: NaCl, KBr, Na2SO4, Fe(NO3)3
1.3.2. Công thức hóa học
Công thức: MxAy
- M: là nguyên tố kim loại
- x: là chỉ số của M
- A: là gốc axít
- y: là chỉ số của gốc axít
1.3.3. Cách đọc tên muối
- Tên muối = tên kim loại (kèm hoá trị kim loại có nhiều hoá trị) + tên gốc axít
- Tên một số gốc muối: -Cl (clorua), =SO4 (sunfat), -NO3 (Nitrat), =CO3 (Cacbonat), -HCO3 (Hiđrocacbonat), -HSO4 (Hiđrosunfat)
- Ví dụ: NaCl (Natri clorua), CaCO3 (Canxi cacbonat), Fe2(SO4)3 Sắt (III) sunfat, KHCO3 (Kali hiđrocacbonat)…
1.3.4. Phân loại muối
- Muối trung hoà: Là muối mà trong gốc axít không có nguyên tử “ H” có thể thay thế bằng nguyên tử kim loại như ZnSO4; Cu(NO3)2…
- Muối axít: Là muối mà trong đó gốc axít còn nguyên tử “H” chưa được thay thế bằng nguyên tử kim loại như NaHCO3; Ca(HCO3)2…
1.4. Tổng kết
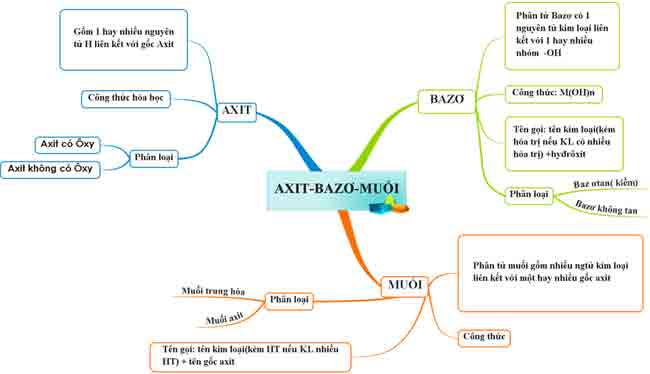
Bài tập minh họa
Bài tập minh họa