Giải bài 1 trang 74 SGK Hóa 10
Bài 1 (trang 74 SGK Hóa 10): Số oxi hóa của nitơ trong NH4+, NO2– và HNO3 lần lượt là:
A. +5, – 3, +3.
B. -3, +3, +5.
C. +3, -3, +5.
D. +3, +5, -3.
Chọn đáp án đúng
Lời giải:
B đúng.
Gọi số oxi hóa của N trong các hợp chất là x
Ta có NH4+: x + 4 = 1 ⇒ x = -3 ⇒ Số oxi hóa của N trong NH4+ là -3
NO2–: x + 2.(-2) = -1 ⇒ x = 3 ⇒ số oxi hóa của N trong NO2– là +3
HNO3: 1 + x + 3.(-2) = 0 ⇒ x = 5 ⇒ số oxi hóa của N tròng HNO3 là +5
Giải bài 2 trang 74 SGK Hóa 10
Bài 2 (trang 74 SGK Hóa 10): Số oxi hóa của Mn, Fe trong Fe3+, S trong SO3, P trong PO43- lần lượt là:
A. 0, +3, +6, +5.
B. 0, +3, +5, +6.
C. +3, + 5, 0, +6.
D. +5, +6, +3, 0.
Chọn đáp án đúng.
Lời giải:
A đúng.
Mn là đơn chất nên có số oxi hóa 0
Fe3+ có số oxi hóa +3
SO3: x + 3.(-2) = 0 ⇒ x = 6 ⇒ số oxi hóa của S là +6
PO43-: x + 4.(-2) = -3 ⇒ x = 5 ⇒ số oxi hóa của P là +5
Giải bài 3 trang 74 SGK Hóa 10
Bài 3 (trang 74 SGK Hóa 10): Hãy cho biết điện hóa trị của các nguyên tử trong các hợp chất sau đây: CsCl, Na2O, BaO, BaCl2, Al2O3.
Lời giải:
Cs = 1+; Cl = 1–; Na = 1+; O = 2–; Ba = 2+; O = 2–
Ba = 2+; Cl = 1–; Al = 3+; O = 2–
Giải bài 4 trang 74 SGK Hóa 10
Bài 4 (trang 74 SGK Hóa 10): Hãy xác định cộng hóa trị của các nguyên tố trong các hợp chất sau đây: H2O, CH4, HCl, NH3.
Lời giải:
Cộng hóa trị của các nguyên tố trong hợp chất:
| H2O | CH4 | HCl | NH3 | |
| Cộng hóa trị | H có cộng hóa trị là 1. O có cộng hóa trị là 2 | C có cộng hóa trị là 4. H có cộng hóa trị là 1 | H và Cl đều có cộng hóa trị là 1 | N có cộng hóa trị là 3. H là cộng hóa trị là 1 |
Giải bài 5 trang 74 SGK Hóa 10
Bài 5 (trang 74 SGK Hóa 10): Xác định số oxi hóa của các nguyên tố trong các phân tử và ion sau: CO2, H2O, SO3, NH3, NO, NO2, Na+, Cu2+, Fe2+, Fe3+, Al3+.
Lời giải:
O có số oxi hóa -2, H có số oxi hóa + 1
⇒ Số oxi hóa của các nguyên tố trong các phân tử và ion là:
CO2: x + 2.(-2) = 0 ⇒ x = 4 ⇒ C có số oxi hóa +4 trong CO2
H2O: H có số oxi hóa +1, O có số oxi hóa -2.
SO3: x + 3.(-2) = 0 ⇒ x = 6 ⇒ S có số oxi hóa +6 trong SO3
NH3: x + 3.1 = 0 ⇒ x = -3 ⇒ N có số oxi hóa -3 trong NH3
NO: x + 1.(-2) = 0 ⇒ x = 2 ⇒ N có số oxi hóa +2 trong NO
NO2: x + 2.(-2) = 0 ⇒ x = 4 ⇒ N có số oxi hóa +4 trong NO2
Cu2+ có số oxi hóa là +2.
Na+ có số oxi hóa là +1.
Fe2+ có số oxi hóa là +2.
Fe3+ có số oxi hóa là +3.
Al3+ có số oxi hóa là +3.
Giải bài 6 trang 74 SGK Hóa 10
Bài 6 (trang 74 SGK Hóa 10): Viết công thức phân tử của những chất, trong đó S lần lượt có số oxi hóa -2, 0, +4, +6.
Lời giải:
Công thức phân tử của những chất trong đó S có số oxi hóa -2, 0, +4, +6 lần lượt là : H2S, S, SO2, SO3.
Giải bài 7 trang 74 SGK Hóa 10
Bài 7 (trang 74 SGK Hóa 10): Xác định số oxi hóa của các nguyên tố trong các hợp chất, đơn chất và ion sau:
a) H2S, S, H2SO3, H2SO4.
b) HCl, HClO, NaClO2, HClO3, HClO4.
c) Mn, MnCl2, MnO2, KMnO4.
d) MnO4–, SO42-, NH4+.
Lời giải:
a) O có số oxi hóa -2, H có số oxi hóa +1 trong các hợp chất.
⇒ Số oxi hóa của S trong các chất :
H2S: 1.2 + x = 0 ⇒ x = -2 ⇒ số oxi hóa của S là -2 trong H2S
S đơn chất có số oxi hóa 0
H2SO3: 1.2 + x + 3.(-2) = 0 ⇒ x= 4 ⇒ S có số oxi hóa +4 trong H2SO3
H2SO4: 1.2 + x + 4.(-2) = 0 ⇒ x = 6 ⇒ S có số oxi hóa +6 trong H2SO4
b)Tương tự số oxi hóa của Cl trong các hợp chất là:
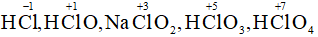
c) Tương tự số oxi hóa của Mn trong các chất:
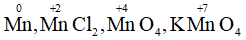
d) Tương tự số oxi hóa của Mn trong các chất
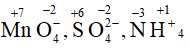
Lý thuyết Hóa trị và số oxi hóa
I. Hóa trị
a/ Hóa trị trong hợp chất ion
-Trong các hợp chất ion , hóa trị của 1 nguyên tố bằng điện tích của ion và được gọi là điện hóa trị của nguyên tố đó.
Ví dụ: Trong hợp chất NaCl , Na có điện hóa trị 1+ và Cl có điện hóa trị 1–
Trong hợp chất CaF2, Ca có điện hóa trị 2+ và F có điện hóa trị 1–
– Quy ước , khi viết điện hóa trị của nguyên tố , ghi giá trị điện tích trước, dấu của điện tích sau.
– Các nguyên tố kim loại thuộc nhóm IA , IIA , IIIA có số electron ở lớp ngoài cùng là 1, 2, 3 có thể nhường nên có điện hóa trị là 1+ , 2+ , 3+
– Các nguyên tố phi kim thuộc nhóm VIA , VIIA nên có 6, 7 electron lớp ngoài cùng, có thể nhận thêm 2 hay1 electron vào lớp ngoài cùng , nên có điện hóa trị 2– , 1–
b/ Hóa trị trong hợp chất cộng hóa trị
Quy tắc : Trong các hợp chất cộng hóa trị, hóa trị của 1 nguyên tố được xác định bằng số liên kết cộng hóa trị của nguyên tử nguyên tố đó trong phân tử và được gọi là cộng hóa trị của nguyên tố đó.
Ví dụ: Hoá trị các nguyên tố trong phân tử nước và metan
H – O – H
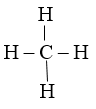
Trong H2O : Nguyên tố H có cộng hóa trị 1 , nguyên tố O có cộng hóa trị 2
Trong CH4 : Nguyên tố C có cộng hóa trị hóa trị 4 , nguyên tố H có cộng hóa trị 1
II. Số oxi hóa
a/ Số OXH của 1 nguyên tố trong phân tử là điện tích của nguyên tử nguyên tố đó trong phân tử, nếu giả định rằng mọi liên kết trong phân tử đều là liên kết ion.
b/ Các quy tắc xác định số OXH
Quy tắc 1 : Số OXH của các nguyên tố trong các đơn chất bằng không
Quy tắc 2 : Trong 1 phân tử, tổng số OXH của các nguyên tố bằng 0
Quy tắc 3 : Số OXH của các ion đơn nguyên tử bằng điện tích của ion đó . Trong ion đa nguyên tử , tổng số OXH của các nguyên tố bằng điện tích của ion.
Quy tắc 4 : Trong hầu hết các hợp chất, số OXH của H bằng +1 , trừ 1 số trường hợp như hidrua, kim loại (NaH , CaH2 ….) . Số OXH của O bằng –2 trừ trường hợp OF2 , peoxit (chẳng hạn H2O2 …)
Lưu ý: Số OXH được viết bằng chữ số thường dấu đặt phía trước và được đặt ở trên kí hiệu nguyên tố.
Ví dụ: Tính oxi hóa của nguyên tố nitơ trong amoniac NH3
Đặt x là số oxi hóa của nguyên tố nitơ
Ta có x+3.1=0 ⇒ x= -3. Số OXH của N trong NH3 là -3